기술&제품
[배터리101] 배터리의 화학 이야기
2024.06.07
|
명사 뒤에 붙는 숫자 ‘101[wʌ́nouwʌ́n]’은 기초 과정, 입문, 기본이라는 뜻입니다. '배터리101'은 배터리가 궁금한 모든 이들을 위한 입문서로, 배터리의 역사부터 기초 원리, 구동 원리 등 기술적인 부분과 IT, 전기자동차, ESS 등 산업적인 부분, 그리고 차세대 기술과 삼성SDI가 열어갈 미래의 모습이 담겨있습니다. 배터리가 만들어갈 더 나은 세상은 우리의 상상보다 무한할 것이기에, ‘배터리101’을 통해 그 세상 속에서 삼성SDI의 역할을 되새기면 좋겠습니다. |
이온화 경향으로 전기를 만든다
배터리는 화학에너지를 기반으로 전기를 발생하는 장치입니다. 따라서 배터리를 깊이 있게 이해하고자 한다면 화학을 먼저 알아야 합니다. 가장 먼저 살펴볼 내용은 ‘이온화 경향’입니다.
이를 위해, 잠시 앞서 소개한 볼타전지에 대해 이야기해 보겠습니다. 볼타는 은(또는 구리)과 아연판 사이에 소금물을 적신 종이를 끼우고 겹겹이 쌓아 올려 전기가 흐르는지를 실험했습니다. 이후에는 두 종류의 다른 금속을 산성 용액에 넣고, 잠기지 않은 두 끝을 연결했을 때 전기가 흐르는 것을 발견했습니다. 이 원리를 이용해 최초의 화학전지인 볼타전지를 만든 것입니다. 여기에서 사용된 두 종류의 금속과 산성 용액이 선택된 기준에 대한 해답을 알려주는 것이 바로 이온화 경향입니다.
금속을 포함한 원소들은 공기나 물에 대한 반응성이 다릅니다. 예를 들어 철(Fe)은 공기나 물속에 두면 쉽게 녹슬지만, 금은 어디에 있든 산화 흔적을 찾아볼 수 없습니다. 이는 각각의 원자 구조가 다르기 때문입니다. 원자가 전자를 잘 내어줄수록 공기와 물에 잘 반응하고 이온화 경향이 큰 금속이 됩니다.
아래 표는 이온화 경향을 기준으로 반응성이 큰 순서대로 금속 원소들을 나열한 것입니다. 리튬(Li)이 가장 앞에 있고 금(Au)이 가장 마지막에 있습니다. 볼타가 배터리에 사용했던 아연(Zn)도 확인할 수 있습니다.
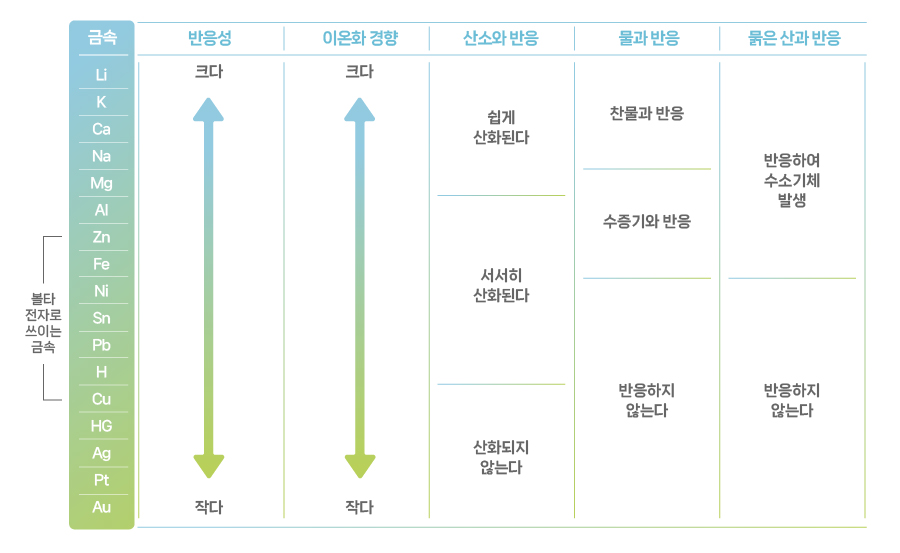
[원소의 이온화 경향]
다시 볼타전지를 설명해 보겠습니다. 전해질은 산성 용액으로 수소(H)를 포함합니다. 수소를 기준으로 아연(Zn)은 이온화 경향이 크고 구리(Cu)는 이온화 경향이 작습니다. 따라서 아연은 산성 용액에 녹고 구리는 산성 용액에 녹지 않습니다. 산성 용액에 녹은 아연은 양이온(+)으로 떨어져 나오고 아연판에는 전자(-)만 남습니다. 좁은 아연판 속에서 오갈 데 없어진 전자는 전선을 타고 구리판으로 넘어가며 전기가 통하게 됩니다. 구리판으로 넘어간 전자는 산성 용액에 남아 있는 수소 이온과 반응해 수소기체(H2)를 만들면서 모든 반응이 끝납니다.
화학전지에서 전기가 발생하는 근본적인 이유는 양극과 음극, 전해질로 사용되는 물질 사이의 이온화 경향 차이 때문입니다. 두 금속과 전해질 간의 이온화 경향 차이가 클수록 더 강한 전류가 만들어지게 됩니다. 이온화 경향이 큰 금속들은 공기 중에서는 쉽게 산화되어 녹이 슬고, 물에 넣으면 폭발적으로 반응하는 특성을 보입니다. 이온화 경향이 가장 큰 리튬은 이 특성이 매우 두드러지기 때문에 관리가 쉽지 않고 안전에 각별한 주의가 필요합니다.
배터리에는 세 가지 단위가 있다
흔히 배터리를 이야기할 때 와트(W, 출력 단위), 암페어(A, 전류 단위), 볼트(V, 전압 단위) 등의 용어를 접하게 됩니다.
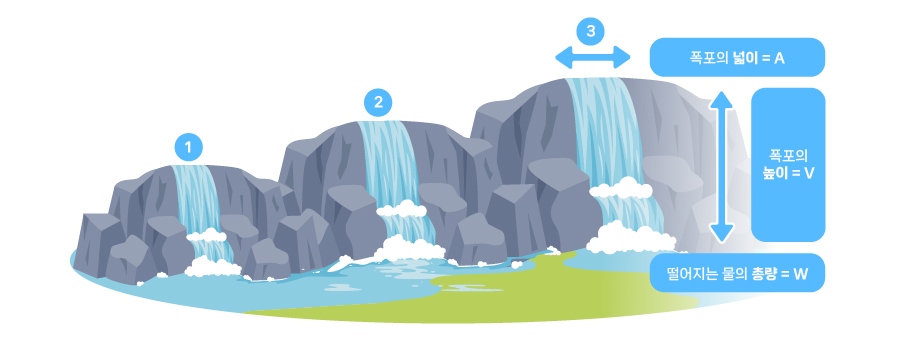
[출력, 전류, 전압의 관계]
위 그림에는 3개의 폭포가 있습니다. 이들 폭포는 각각 폭포의 넓이와 높이, 떨어진 물의 총량이 다릅니다. 1번과 2번을 놓고 보면 더 넓은 2번의 폭포가 더 힘이 셉니다. 넓이가 같은 2번과 3번을 비교하면 더 높은 3번 폭포가 힘이 셉니다.
이를 배터리에 대응해보겠습니다. 3번 폭포는 전압이 높은 배터리입니다. 전압(V, 볼트)은 도체 안에 있는 두 점 사이의 전기적 위치 에너지의 차이를 말하며, 폭포의 높이에 해당합니다. 폭포의 높이가 높을수록, 즉 음극과 양극의 전위차가 클수록 전압은 높게 나타납니다. 전위(電位, electric potential)는 전기장 내에서 단위 전하가 갖는 위치에너지를 뜻합니다. 음극과 양극의 전위차가 클수록 전압은 커집니다. 흔히 가정에서는 220V를 사용하고 산업 현장에서는 380V를 사용합니다. 소형 디지털기기는 5V, 12V, 19V를 사용하는데 비교적 작은 전압으로도 작동이 가능하기 때문입니다.
다음으로 2번은 1번에 비해 전류가 많이 흐르는 배터리입니다. 전류(A, 암페어)란 전기가 흐르는 것을 말합니다. 여기서 암페어(A)는 같은 시간 동안 흘러가는 전기의 양을 나타내는 단위입니다. 1A는 1초 동안 1C(쿨롱, 전하량)의 전하가 이동하는 것을 말합니다.
그렇다면 1, 2, 3번 폭포 중 같은 시간 동안 가장 많은 폭포수를 떨어트린 것은 어느 폭포일까? 답은 3번 폭포입니다. 출력(W, 와트)이 가장 큰 배터리라고 할 수 있습니다. 출력은 1초 동안 소비되는 전기에너지를 기준으로 합니다. 배터리의 출력은 전압과 전류를 곱해 계산합니다. 예를 들면 전압 220V에 전류 10A는 출력 2,200W입니다. 흘러내린 폭포수 전체의 양을 계산하기 위해서, 단위 시간 당 흘러내린 폭포수의 양과 시간을 곱하는 것과 같은 원리입니다.
출력(W) = 전압(V) × 전류(A)
더 나아가, 배터리에 주로 사용되는 용량(Ah), 에너지(Wh), 에너지 밀도(Wh/L), (Wh/kg)에 대해서 알아보겠습니다. 전기를 폭포에 비유한다면 배터리는 댐에 비유할 수 있습니다. 배터리는 전기를 가두고 사용하는데, 이를 다 쓰면 새로 채워야 하기 때문입니다. 따라서 배터리에서 용량이란 저장된 전기의 총량을 뜻합니다. 댐에 비유하자면, 저장된 물의 총량과 같습니다. 용량은 장착된 기기의 작동시간을 결정하므로 용량이 클수록 기기의 작동시간 또한 길어집니다. 용량은 전류와 시간의 곱(A×hour)으로 구하며 단위는 암페어시(Ah)를 씁니다.
배터리에서 말하는 에너지는 저장된 전기가 가진 총 에너지입니다. 댐에 저장된 물이 가진 총 에너지라고 비유할 수 있습니다. 에너지는 전압과 전류에 비례하며, 전압과 전류와 시간의 곱(V×A×hour)으로 구하고 단위는 와트시(Wh)를 씁니다.
마지막으로 에너지 밀도란 동일 부피 혹은 동일 무게의 배터리에 저장된 전기에너지를 말합니다. 동일 한 부피의 댐에 저장된 물의 에너지라고 볼 수 있습니다. 이는 전기에너지를 부피 또는 무게로 나누어(Wh÷1L 또는 Wh÷1kg) 구하고, 배터리 1L 혹은 1kg에 담긴 에너지를 확인할 수 있습니다. 에너지 밀도의 단위는 Wh/l 또는 Wh/kg입니다.
전압을 올리고 싶다면, 배터리는 직렬로 연결해야 합니다. 배터리는 직렬로 연결하면 전압이 올라가고 병렬로 연결하면 전류가 커집니다. 그리고 배터리를 충전할 때 전압과 전류는 모두 높은 것이 유리합니다. 전압이 높으면 강한 전기가 들어가고, 전류가 세면 한꺼번에 많은 전류가 흐를 수 있기 때문입니다.
표준환원전위는 배터리의 전력을 알려준다
배터리에는 1.5V 혹은 3.5V와 같은 표기 형식이 있습니다. 이처럼 세상의 모든 배터리는 고유한 전압을 갖고 있습니다. 이처럼 배터리가 고유 전압에 맞는 전력을 생산할 수 있는 이유는 ‘표준환원전위’에 있습니다.
여러 차례 언급했듯, 현대 배터리의 원형을 만든 볼타는 이온화 경향에 기초해 양극과 음극을 선택했습니다. 전자를 잘 내놓는, 즉 이온화 경향이 큰 금속이 산화 반응을 잘 일으켰기 때문입니다. 볼타는 이러한 이온화 경향을 바탕으로 기본적인 배터리의 형태는 만들 수 있었지만 전압이 높고 지속성이 긴 배터리를 만들지는 못했습니다.
이온화 경향만으로 배터리를 만드는 데는 한계가 있었습니다. 이온화 경향이 큰 금속과 작은 금속을 구분할 수는 있지만 구체적으로 그 차이가 어느 정도인지는 알 수 없었기 때문입니다. 같은 이유로, 두 개의 금속을 선택해 배터리를 만들었다고 해도 실제 전압을 측정하기 전까지는 배터리가 만들 전압을 가늠하기가 어려웠습니다. 이처럼 이론적 값을 측정할 수 없는 실험은 난항을 겪기 마련입니다.
물론 오늘날 이러한 어려움은 모두 사라졌습니다. 이온화 경향을 구체적인 값으로 나타낸 표인 표준환원전위(Standard Reduction Potential, 기호 E°)가 완성되었기 때문입니다.
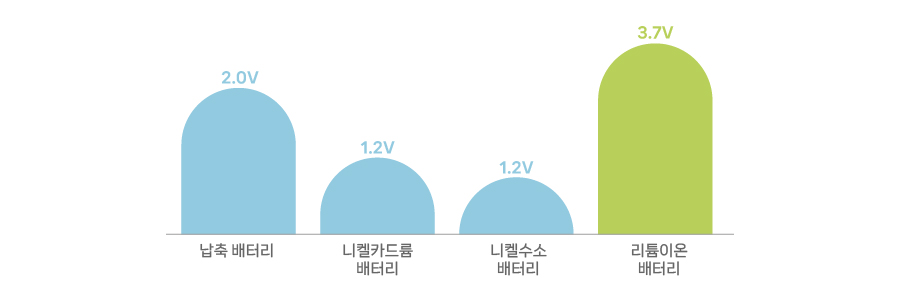
[2차전지의 기전력]
화학전지에서 산화와 환원 반응으로 만들어진 배터리의 전압을 ‘기전력’이라고 합니다. 기전력이란 양극과 음극의 전위차를 말하는 것으로 전위차가 클수록 기전력, 즉 전압이 올라갑니다. 그렇다면 각각의 금속이 갖는 전위값, 즉 표준환원전위는 어떻게 구할까? 우선 전위를 알고자 하는 금속을 양극으로 두고 표준수소전극(SHE, Standard Hydrogen Electrode)을 음극으로 하는 배터리를 만든 후 나타나는 기전력을 확인하면 됩니다. 모든 금속은 동일한 환경에서 기전력이 측정되어야 하며, 온도와 기압은 물론 수소전극도 같은 상태여야 합니다. 이것이 수소전극에도 표준이라는 수식어를 붙이는 이유입니다.
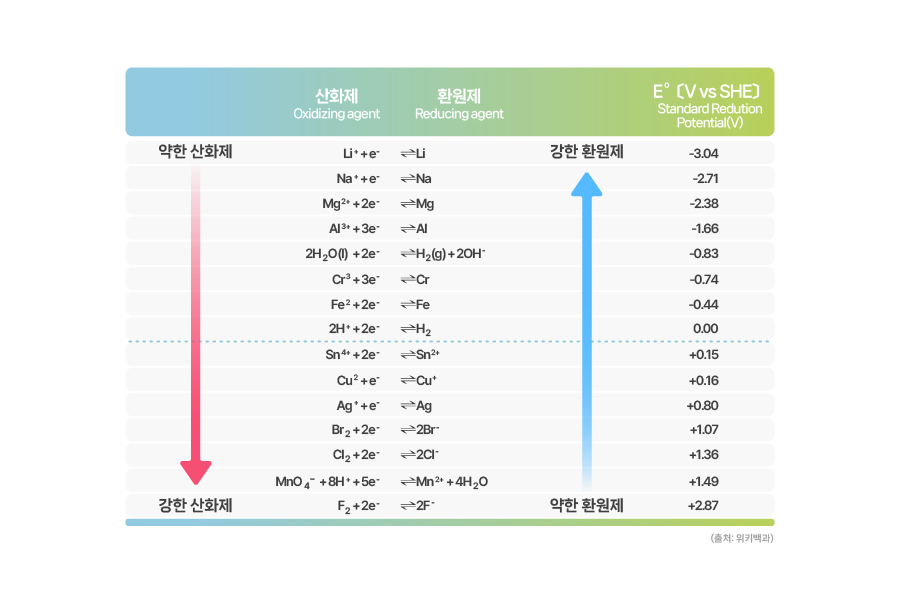
[표준환원전위]
그렇게 해서 이온화 경향에 나오는 모든 금속의 표준환원전위를 측정한 값은 위 표와 같습니다. 이온화 경향이 클수록 표준환원전위가 작은 것을 확인할 수 있으며, 표준환원전위가 작을수록 금속의 반응성은 커집니다.
표를 보면 수소의 표준환원전위는 0입니다. 음극에 동일 원소인 수소를 사용했으므로 산화와 환원 반응이 일어나지 않기 때문입니다. 수소의 환원전위보다 더 크다면 환원이 잘 된다는 의미이고, 반대라면 환원 대신 산화하려는 성질이 더 크다는 의미입니다.
표준환원전위가 큰 금속을 양극 단자에 연결하고 작은 것을 음극 단자에 연결하면, 자발적으로 구동되는 화학전지를 구성할 수 있습니다. 또한 표준환원전위 표를 통해 배터리의 이론적 기전력도 쉽게 계산할 수 있습니다.
