기술&제품
[배터리101] 1차전지와 2차전지의 차이점
2024.05.24
|
명사 뒤에 붙는 숫자 ‘101[wʌ́nouwʌ́n]’은 기초 과정, 입문, 기본이라는 뜻입니다. '배터리101'은 배터리가 궁금한 모든 이들을 위한 입문서로, 배터리의 역사부터 기초 원리, 구동 원리 등 기술적인 부분과 IT, 전기자동차, ESS 등 산업적인 부분, 그리고 차세대 기술과 삼성SDI가 열어갈 미래의 모습이 담겨있습니다. 배터리가 만들어갈 더 나은 세상은 우리의 상상보다 무한할 것이기에, ‘배터리101’을 통해 그 세상 속에서 삼성SDI의 역할을 되새기면 좋겠습니다. |
1차전지는 충전할 수 없다
1차전지와 2차전지의 차이를 한마디로 정리하면, 재사용 가능 여부입니다. 1차전지는 한 번 사용하면 재사용이 불가능하지만 2차전지는 지속적으로 사용할 수 있습니다. 우리가 사용하는 대부분의 배터리는 화학전지(chemical cell)로 물질의 변화를 통해 에너지가 만들어집니다. 구체적으로 화학전지는 산화와 환원 반응을 이용해 화학에너지를 전기에너지로 바꿉니다.

[산화과정]
산소와 결합하는 반응을 산화, 산소를 잃게 되는 반응을 환원이라고 합니다. 쉬운 예를 들어보겠습니다. 사과를 잘라서 상온에 뒀을 때, 시간이 지남에 따라 사과의 하얀 속살은 갈색으로 변합니다. 철이 녹스는 것도 마찬가지입니다. 광택이 들었던 못과 삽은 시간이 지나면 녹이 슬게 됩니다. 사과를 갈색으로 바꾸고 철을 녹슬게 한 것은 공기입니다. 엄밀히 말하면, 공기 중에 포함된 수많은 기체 중 산소 때문입니다. 이처럼 산소는 분자나 원자와 결합할 때 갈변이나 부식 등의 반응을 일으킵니다.
산소의 원자번호는 8번입니다. 원자를 보면, 핵에는 8개의 양성자가 있고 최외각에는 6개의 전자가 있습니다. 이 전자들은 매우 불안정한 상태입니다. 최외각에 있는 전자는 8개일 때 가장 안정적이기 때문입니다. 따라서 이 불안정한 전자 6개는 다른 곳에서 2개의 전자를 가져오려는 특징이 있습니다. 그래서 어떤 물질이든 산소와 결합하면 전자를 빼앗기고 성잘이 변하게 되는 것입니다.
산소의 산화와 환원 반응을 연구하던 화학자들은 여러 물질을 연구하면서 산소가 아닌데도 전자를 빼앗고 돌려주는 일이 부지기수로 일어나는 것을 발견했습니다. 그때마다 새로운 이름을 붙일 수는 없었기에, 화학자들은 어떤 물질이든 전자를 잃을 때는 산화라고 하고 얻을 때는 환원이라는 개념을 사용하기로 합의했습니다.
화학전지는 전자의 이동으로 나타나는 화학에너지를 전기에너지로 바꾸며, 금속을 소재로 많이 사용합니다. 전자를 잘 빼앗는 물질들은 주로 비금속이고 전자를 잘 잃어버리는 물질들은 주로 금속이기 때문입니다. 1차전지 역시 양극과 음극에 금속을 사용합니다. 산화 경향이 큰 금속은 양극에 배치하고, 환원 경향이 큰 금속은 음극에 배치하는 것이 기본 원리입니다.
처음으로 돌아가서, 1차전지를 충전할 수 없는 이유에 대해 설명하겠습니다. 가장 먼저 1차전지를 만드는 과정에는 충전이라는 단계가 없습니다. 이는 한 번 충전해서 한 번 사용하는 배터리도 아닙니다. 그렇다면 충전도 하지 않은 배터리를 어떻게 사용할 수 있을까?
1차전지는 음극이 내보낸 이온을 양극이 받는 과정에서 발생하는 전기를 사용하는데, 이를 방전이라고 합니다. 1차전지가 방전되는 과정에서 양극과 음극, 전해질에는 변화가 나타납니다. 금속의 결합 구조가 바뀌면서 성질과 모양이 변하고, 전해질의 성분도 바뀝니다. 이러한 변화는 비가역적입니다. 한 번 반응이 일어난 후에는 이전의 상태로 되돌아갈 수 없다는 뜻입니다. 변색된 사과나 녹슨 못이 이전 상태로 돌아가지 못하는 것처럼, 1차전지 역시 방전 후에는 이전 상태로 되돌릴 수 없습니다. 이것은 1차전지와 2차전지를 구분하는 대표적인 특징이기도 합니다. 1차전지와 달리 2차전지의 화학 반응은 가역 반응, 즉 되돌릴 수 있는 반응입니다. 이러한 차이로 1차전지는 충전 과정을 거친다 해도 다시 사용할 수 없습니다.
그런데 누군가 1차전지를 2차전지로 오해하고 충전기에 꽂는다고 가정해 봅시다. 예를 들어 알칼리망간건전지의 음극과 양극에 전기를 연결하고 충전을 시도하는 것입니다. 아마도 수분 내에는 별다른 변화가 감지되지 않을 것입니다. 그러나 장시간 두면 문제가 발생합니다. 방전된 건전지에 전기를 통하게 하면 전기가 전해질에 포함된 물과 반응해 전기분해가 일어납니다. 알칼리망간건전지의 음극과 양극의 성분이 달라서, 음극에서는 수소기체가 발생하고 양극에서는 산소기체가 발생합니다. 여기서 만일 두 기체가 섞이면 대폭발까지 일어날 수 있습니다. 이러한 이유로 알칼리망간건전지에는 충전 금지라는 주의사항이 붙어 있습니다. 대부분의 1차전지에 전기를 통하게 하면 기체가 발생하므로 이는 매우 위험합니다.
2차전지는 충방전이 가능하다
이번에는 2차전지가 충방전이 가능한 원리를 납축 배터리를 통해 설명해 보겠습니다.
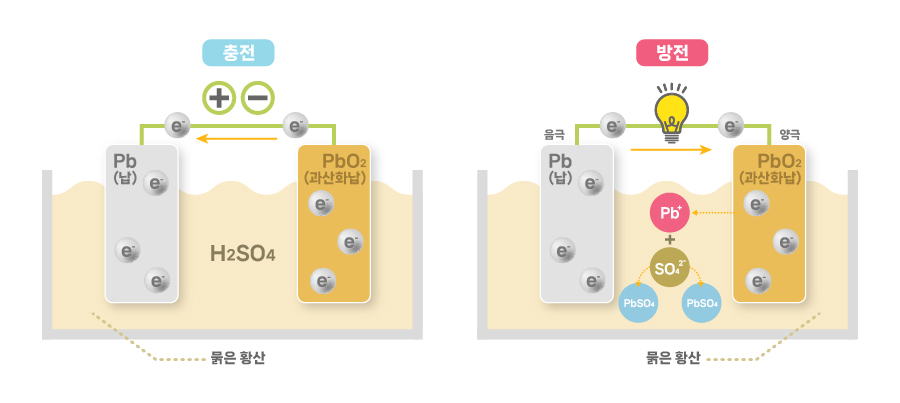
[납축 배터리의 원리]
납축 배터리는 양극판, 음극판, 전해질로 이루어져 있습니다. 완충 상태의 납축 배터리에는 양극의 과산화납과 음극의 납, 그리고 물과 묽은 황산이 섞인 전해액이 있습니다. 방전 과정에서는 양극과 음극의 과산화납과 납이 모두 황산납으로 바뀌고, 전해액 속의 황산은 줄어들어 물이 많아집니다. 반대로 완전히 충전되면 극판의 황산 비중이 줄어들고 전해액에는 황산 비중이 높아집니다. 다시 말해 양극은 과산화납, 음극은 납으로 돌아가고 전해액도 물과 묽은 황산이 섞인 상태가 됩니다. 이처럼 납축 배터리는 방전 시에 음극에서는 산화 반응이 일어나고, 양극에서는 환원 반응이 일어납니다. 충전 시에는 반대로 음극에서 환원 반응이 일어나고 양극에서 산화 반응이 일어납니다. 모두 가역 반응이기 때문에 충전과 방전을 지속할 수 있습니다.
앞서 소개한 바와 같이, 납축 배터리는 1859년에 발명된 이후 현재까지 자동차용 배터리로 쓰이고 있습니다. 오래도록 산업 현장에서 사용된 만큼 납축 배터리는 장점이 많습니다. 가장 큰 장점은 싼 가격입니다. 납은 비철금속으로 아연보다 저렴하고 니켈에 비해 1/5에서 1/10 수준으로 저렴해 재료 수급이 쉽습니다. 구조가 간단해 유지보수도 쉬운 편입니다. 더불어 전해질의 영향으로 저온과 고온 방전이 우수하며, 짧은 시간 동안 강한 전류를 방전합니다.
하지만 납축 배터리는 수명이 짧고 에너지 밀도가 낮다는 치명적인 단점이 있습니다. 자동차용 납축 배터리는 큰 상자처럼 생겼는데, 그 안에는 2.1볼트의 전력을 가진 셀 6개가 들어가 있습니다. 이들 셀을 직렬로 연결해야 12~13볼트의 필요 전력을 맞출 수 있습니다. 이밖에도 비교적 자기방전이 심하고 방전 후 장기 보전이 어려운 점, 작은 사이즈로 개발이 어려운 점, 주재료인 납이 중금속이라는 점, 수소가스 발생으로 화기에 주의해야 한다는 점 등이 단점입니다. 이러한 이유로 납축 배터리는 새로운 2차전지의 보급과 함께 2010년대 중반 이후로 정체되어 있습니다.
2차전지의 가격을 내리고 성능을 올린다
최근 들어 충방전이 가능해 오래 사용할 수 있는 2차전지가 환경문제를 해결할 수 있는 솔루션으로 각광받고 있습니다. 용량은 커지고 부피가 작아진 배터리가 등장함에 따라, 해당 산업이 ‘미래 산업’으로 지목되면서 기대와 관심도 날로 커지는 상황입니다. 그 발전사를 개괄적으로 살펴보겠습니다.
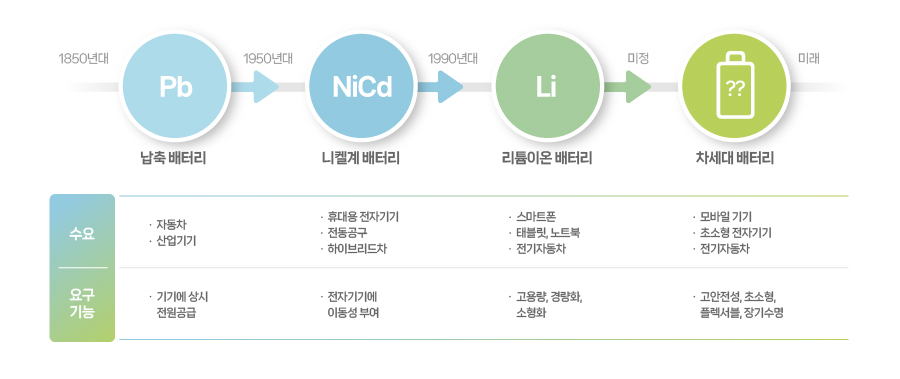
[2차전지의 발전사]
최초의 2차전지인 납축 배터리는 충방전이 가능한 장점이 있지만, 부피가 크고 수명이 짧다는 한계 때문에 산업 전반으로 확산되지 못했습니다. 자동차와 산업기기의 구동에 필요한 보조장치로써 사용되는 정도였습니다. 많은 연구자들은 이러한 단점을 해소하고 장점을 배가한 새로운 2차전지를 개발해야 한다는 열정을 불태웠습니다. 이 부분에서 납축 배터리는 2차전지 산업의 성장을 이끌었다고 할 수 있습니다.
이후 2차전지에 이름을 올린 배터리는 1948년에 발명된 니켈카드뮴 배터리입니다. 니켈카드뮴 배터리는 납축 배터리보다 튼튼하고 충격에 강하며 밀폐형으로 만들 수 있어 휴대용 면도기, 무선 전화기, 전동공구에 사용되었고 휴대기기의 성장세와 함께 새로운 시장의 주역으로 성장했습니다. 하지만 완전히 방전되지 않은 상태에서 충전하면 배터리의 성능이 저하되는 ‘메모리 효과’ 때문에 소비자의 만족도가 떨어졌습니다. 이타이이타이병을 일으키는 등 인체에 유해한 카드뮴을 사용한다는 것도 문제로 지적되었습니다.
1990년, 니켈카드뮴 배터리의 문제를 해결하기 위해 니켈수소 배터리가 등장했습니다. 니켈수소 배터리는 니켈카드뮴 배터리에 비해 용량이 2배에 달하고 안전성이 높아 핸드폰과 노트북 등 새롭게 등장한 전자기기에 채용되었습니다. 하지만 1990년대 중반 리튬이온 배터리가 보급되면서 성장세가 큰 폭으로 둔화했습니다. 리튬이온 배터리가 고용량과 장수명으로 시장을 확대하는 사이, 니켈카드뮴 배터리의 에너지 밀도는 큰 폭으로 개선되지 않았기 때문입니다.
오늘날 2차전지의 대표 선수로 꼽히는 리튬이온 배터리는 1990년대 초반에 등장했습니다. 1개의 배터리만으로 니켈계 배터리 3개를 대체하는 리튬이온 배터리는 휴대용 전자기기에 필수품으로 자리잡았습니다. 또한 간헐적이고 반복적인 충전에도 메모리 효과가 나타나지 않아, 핸드폰과 노트북에 매우 적합한 기능을 수행했습니다. 이처럼 월등한 성능을 자랑한 리튬이온 배터리는 1990년대 중반 고급 사양의 모델에 채용되었고, 2000년대 중반에는 전 기종으로 확산되었습니다.

[화학전지의 분류]
리튬이온 배터리의 확산을 이끈 가장 강력한 동력은 꾸준한 가격 하락이었습니다. 블룸버그 자료에 따르면 2013년 KWh당 780달러였던 리튬이온 배터리 팩 가격이 2023년에는 약 139달러로 떨어졌습니다. 10년 사이 무려 82% 가량 떨어진 것입니다. 오늘날 우리가 누리는 리튬이온 배터리의 편익은 상당합니다.
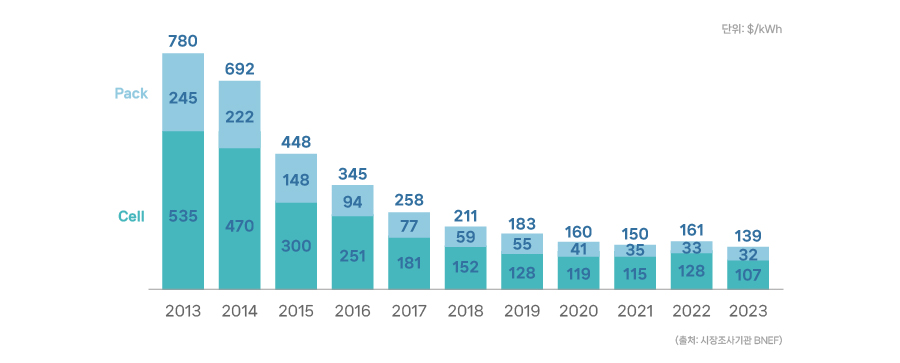
[리튬이온 배터리의 가격 변화]
